Урок в 10 классе «Применение газов в технике»
Цель: Изучить свойства газов и их применение в технике
Задачи: воспитательные :
развивающие :
образовательная
Ход урока
Орг.момент
Проверка домашнего задания (тест)
Организация работ учащихся по группам
Выступление групп
Домашнее задание
Тест
1. Количество вещества измеряется в:
А. молекулах
В. атомах
Г. килограммах
Е. кг/моль
2. Молярная масса – это:
А. масса вещества
Б. масса одного моля вещества
В. относительная молекулярная масса
Г. масса одной молекулы (одного атома)
Д. количество вещества
Е. 1/12 массы атома углерода
3. Постоянная Авогадро численно равна:
4. Постоянная величина в уравнении Клапейрона называется:
А. постоянной Авогадро
Б. постоянной Больцмана
В. универсальной газовой постоянной
Г. абсолютной температурой
Д. количеством вещества
Е. молярной массой
5. При изотермическом процессе:
А. при увеличении давления объём уменьшается
Б. при увеличении давления объём увеличивается
В. давление и объём не меняются
Г. при уменьшении давления объём уменьшается
Д. при увеличении температуры объём увеличивается
Е. при увеличении объёма температура уменьшается
6. Постоянная Авогадро – это:
А. масса одного моля вещества
Б. число молекул в единице объёма вещества
В. число молекул в моле вещества
Г. универсальная газовая постоянная
Д. отношение массы вещества к его молярной массе
Е. отношение числа молекул вещества к числу молекул в моле вещества
7. Количество вещества равно отношению:
А. массы молекулы (атома) к молярной массе
Б. молярной массы к постоянной Авогадро
В. массы вещества к относительной молекулярной массе
Г. числа молекул (атомов) к постоянной Авогадро
Д. числа молекул (атомов) к молярной массе
Е. массы молекулы (атома) к постоянной Авогадро
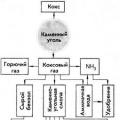
Класс делится на группы, по заданным материалам учащиеся готовят кластер и защищают его.
Материал к подготовки
Свойства газов
Газ (газообразное состояние) (от нидерл. gas, восходит к др.-греч. χάος) - одно из четырех агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Так же термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости. В этом и заключается отличие газа от пара. При повышении давления насыщенный пар частично превращается в жидкость, газ нет.
Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдойфазы этого же вещества, обычно называется паром.
Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда).
Газообразное состояние - самое распространённое состояние вещества Вселенной (межзвёздное вещество, туманности, звёзды, атмосферы планет и т. д.). По химическим свойствам газы и их смеси весьма разнообразны - от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц - фотонов, электронов, броуновских частиц, а также плазму.
Важнейшей чертой теплового движения молекул газа - это беспорядочность (хаотичность) движения. Экспериментальным доказательством непрерывного характера движения молекул является диффузия и броуновское движение.
Диффузия - это явление самопроизвольного проникновения молекул одного вещества в другое. В результате взаимной диффузии веществ происходит постепенное выравнивание их концентрации во всех областях занимаемого ими объёма. Установлено, что скорость протекания процесса диффузии зависит от рода веществ и температуры.
Одним из самых интересных явлений, подтверждающих хаотичность движения молекул, является броуновское движение, которое проявляется в виде теплового движения микроскопических частиц вещества, находящиеся во взвешенном состоянии в газе. Это явление в 1827 году впервые наблюдал Р. Браун, от имени которого оно получило название. Беспорядочность перемещения таких частиц объясняется случайным характером передачи импульсов от молекул газа частице с разных сторон. Броуновское движение оказывается тем заметнее, чем меньше частица и чем выше температура системы. Зависимость от температуры свидетельствует о том, что скорость хаотического движения молекул возрастает с увеличением температуры, именно поэтому его и называют тепловым движением.
Газ как амортизатор
Амортизатор можно с уверенностью назвать важнейшим компонентом подвески любого автомобиля. Без этого небольшого узла езда была бы просто невыносимой по причине непрерывной вертикальной раскачки кузова автомобиля. Автомобильный амортизатор играет роль своеобразного демпфера, гасящего колебания пружин, рессор или торсионов. Масса кузова автомобиля распределяется на пружины подвески таким образом, что последние постоянно сжаты на определенную величину в зависимости от веса машины и жесткости пружин. Таким образом, каждое колесо автомобиля имеет возможность перемещаться как вверх, так и вниз относительно кузова. За счет этого достигается постоянный контакт каждого колеса с дорожным покрытием независимо от того попадает колесо на кочку или в яму. Но если бы не было амортизатора, то контакт с дорогой не был бы постоянным из-за колебаний пружин. Многим автолюбителям, наверное, знакомы ощущения, когда колеса машины начинают подпрыгивать на малейшей неровности и даже на скорости от 30 км/ч чувствуется ухудшение контроля над автомобилем. Такие симптомы как раз говорят о вышедшем из строя амортизаторе. Из всего вышесказанного можно понять, что амортизатор служит для гашения излишних колебаний пружин и обеспечения постоянного контакта колес с дорожным покрытием. Разновидности амортизаторов Если спросить любого водителя о том, какие типы амортизаторов ему известны, то ответ будет примерно таков: масляные, газо-масляные и газовые. И это в корне неверно, так как абсолютно во всех автомобильных амортизаторах присутствует масло или другая жидкость (об этом позже). Более корректно амортизаторы можно разделить на масляные и газовые. И если не затрагивать всевозможные пневматические и регулируемые подвески, то амортизаторы бывают одно- и двухтрубные. Двухтрубный масляный (гидравлический) амортизатор Гидравлический двухтрубный амортизатор является самым простым, самым дешевым и, к сожалению, самым нестабильным. Двухтрубный амортизатор состоит из следующих компонентов: цилиндрический корпус (резервуар); рабочий цилиндр; клапан прямого хода (сжатия) встроенный в рабочий цилиндр; поршень; клапан обратного хода (отбоя) встроенный в поршень; шток; кожух. Рабочий цилиндр расположен в корпусе амортизатора, который служит одновременно резервуаром и наполнен определенным количеством масла. Поршень соединен со штоком и располагается в рабочем цилиндре. Принцип работы такого амортизатора весьма прост. При работе на сжатие, поршень со штоком движется вниз и вытесняет масло через клапан прямого хода из рабочего цилиндра в корпус амортизатора. При этом воздух, который находится в верхней части резервуара, немного сжимается. При работе на отбой, поршень движется в обратном направлении и через клапан обратного хода перепускает масло из корпуса в рабочий цилиндр. У гидравлического амортизатора имеется ряд серьезных недостатков. Главным недостатком является нагрев. Как известно гашение одной энергии порождает возникновение другой, так и в амортизаторе – компенсированные колебания пружины превращаются в тепловую энергию и масло соответственно нагревается. Из-за двухтрубной конструкции и сравнительно малого объема, масло быстро нагревается, но плохо охлаждается. Данная проблема автоматически порождает следующую – вспенивание масла. Бороться с этим никак нельзя, но бывалые автолюбители очень часто пытаются избавиться от аэрации, путем заполнения нового амортизатора маслом что называется «под завязку».
Газ как рабочее тело двигателей
Рабо́чее те́ло - в теплотехнике и термодинамике условное несменяемое материальное тело, расширяющееся при подводе к нему теплоты и сжимающееся при охлаждении и выполняющее работу по перемещению рабочего органа тепловой машины. В теоретических разработках рабочее тело обычно обладает свойствамиидеального газа.
На практике рабочим телом тепловых двигателей являются продукты сгорания углеводородного топлива (бензина, дизельного топлива и др.), или водяной пар, имеющие высокие термодинамические параметры (начальные: температура, давление, скорость и т. д.)
В холодильных машинах в качестве рабочего тела используются фреоны, аммиак, гелий, водород, азот
ДВИГАТЕЛЬ ТЕПЛОВОЙ, машина для преобразования тепловой энергии в механическую работу. В тепловом двигателе происходит расширение газа, который давит на поршень, заставляя его перемещаться, или на лопатки колеса турбины, сообщая ему вращение. Примерами поршневых двигателей являются паровые машины и двигатели внутреннего сгорания (карбюраторные и дизельные). Турбины двигателей бывают газовые (например, в авиационных турбореактивных двигателях) и паровые.
В поршневых тепловых двигателях горячий газ расширяется в цилиндре, перемещая поршень, и тем самым совершает механическую работу. Для превращения прямолинейного возвратно-поступательного движения поршня во вращательное движение вала обычно используется кривошипно-шатунный механизм.
В двигателях внешнего сгорания (например, в паровых машинах) рабочее тело нагревают за счет сжигания топлива вне двигателя и подают в цилиндр газ (пар) под высокими температурой и давлением. Газ, расширяясь и перемещая поршень, охлаждается, а давление его падает до близкого к атмосферному. Этот отработанный газ удаляется из цилиндра, а затем в него подается новая порция газа – либо после возврата поршня в исходное положение (в двигателях одинарного действия – с односторонним впуском), либо с обратной стороны поршня (в двигателях двойного действия). В последнем случае поршень возвращается в исходное положение под действием расширяющейся новой порции газа, а в двигателях одинарного действия поршень возвращается в исходное положение маховиком, установленным на валу кривошипа. В двигателях двойного действия на каждый оборот вала приходится два рабочих хода, а в двигателях одинарного действия – только один; поэтому первые двигатели в два раза мощнее при одинаковых габаритах и скоростях.
В двигателях внутреннего сгорания горячий газ, который перемещает поршень, получают за счет сжигания смеси топлива и воздуха непосредственно в цилиндре.
Для подвода свежих порций рабочего тела и выпуска отработанного газа в двигателях применяется система клапанов. Подвод и выпуск газа производятся при строго определенных положениях поршня, что обеспечивается специальным механизмом, который управляет работой впускных и выпускных клапанов.
Разреженные газы
Длина свободного пути молекул обратно пропорциональна давлениюгаза. С разрежением газа она естественно увеличивается, достигая, например, 1 см при давлении 0,009 мм рт. ст. и нескольких километров при высоком разрежении(высоком вакууме). В этих условиях, когда средняя длина пути становится много большей, чем размеры сосуда, столкновения между молекулами газа случаются относительно редко, и каждая данная молекула пролетает от однойстенки сосуда до другой большей частью без столкновений с другими молекулами. В результате такие свойства, как вязкость, диффузия, теплопроводность, которые зависят в основном от межмолекулярных столкновений, существенно меняются. Очень сильное уменьшениетеплопроводности газов при высоком разрежении практически используется в термосах, в производственных и лабораторных сосудах Дьюара. Тепловая изоляция достигается в них в основном именно тем, что сосуды делаются сдвойными стенками и в пространстве между ними создается высокий вакуум.
Шотландский химик Джеймс Дьюар (1842-1923). Он приготовил в большом количествежидкий кислород, который хранил в изобретенном им сосуде, получившем название сосуда Дьюара. Сосуд Дьюара - это колба с двойными стенками, из пространства между которыми выкачан воздух Теплопроводность разреженногогаза между стенками настолько мала, что температура вешества, помешенноро в сосуд, долгое время остается постоянной. Чтобы еще более замедлить процесс передачи тепла, Дьюар посеребрил стенки сосуда, (Бытовой термос - это всего-навсего сосуд Дьюара, закрывающийся пробкой.)
Глубокий вакуум
Для достижения глубокого вакуума, например порядка 10-6 мм рт. ст., используют так называемые диффузионные насосы. Различают два основных типа диффузионных насосов: ртутные и масляные. Они бывают одноступенчатыми и многоступенчатыми, чаще всего двухступенчатыми.
Получение глубокого вакуума
Для достижения глубокого вакуума, например порядка 10-6 мм рт. ст., используют так называемые диффузионные насосы. Различают два основных типа диффузионных насосов: ртутные и масляные. Они бывают одноступенчатыми и многоступенчатыми, чаще всего двухступенчатыми. Принцип устройства обоих типов практически одинаков.
На рис. 1 показана схема стеклянного диффузионного ртутного насоса. Он состоит из резервуара 1 с ртутью, соединенного с холодильником 2. Ртуть доводят до кипения нагреванием газовой горелкой или электропечью. Пары ртути поднимаются по трубке 3, поступают в холодильник, в котором конденсируются и возвращаются в резервуар / по трубке 4. Принцип действия насоса основан на том, что вследствие частичной конденсации паров ртути внутри холодильника вблизи конца трубки 5 давление паров ртути (или иной жидкости) оказывается пониженным. Поэтому газ, находящийся в трубке 6, диффундирует в область с пониженным давлением и затем трубке 7 уносится к форвакуумной части установки
При сравнительно большом давлении в установке пары ртути, выходящие из трубки 5, сталкиваясь с молекулами газа, находящимися около конца этой трубки, отражаются по всем направлениям. Газ, находящийся в Трубке 6, при этом диффундирует во встречный поток паров ртути, еще не успевшей сконденсироваться. Применять диффузионный ртутный насос в таких случаях не следует.
При работе диффузонного насоса необходимо очень внимательно следить за правильным охлаждением конденсационной части. Подавать воду в холодильник следует до начала нагревания печи под резервуаром со ртутью и отключать после прекращения кипения ртути. Однако включать обогрев насоса следует только после того, как форвакуум уже будет создан.
При любом нарушении работы установки следует немедленно выключить нагревание ртутного насоса и до его полного охлаждения ничего не предпринимать для исправления ошибки или аварии. Причинами аварии могут быть: перегрев холодильника в результате остановки или замедления поступления воды, поломка холодильника вследствие усиления тока воды через горячий прибор. Если давление в установке повысится, кипение ртути прекратится, а ее температура начнет подниматься. Авария может произойти и при внезапном вскипании перегретой ртути.
Для получения вакуума порядка 10-6 мм рт. ст. необходимо установить последовательно два одноступенчатых насоса или один двухступенчатый.
На рис. 2 показан двухступенчатый масляный высоковакуумный диффузионный насос с внутренним электрообогревом. Масла в него следует заливать не более 60-70 см3. Нужно следить за тем, чтобы нагревательная спираль была полностью покрыта диффузионным минеральным слоем толщиной до 2 мм. Избыток масла может препятствовать нормальному ходу работы, так как вызывает задержку кипения. Примерно после 15-минутного разогревания, диффузионный насос начинает работать. Если требуется; отключить насос, сперва отключают электронагрев, дают маслу остыть приблизительно до 400C и лишь тогда" выключают охлаждение и проветривают насос.
Диффузионное масло нужно время от времени заменять свежим. О пригодности диффузионного масла можно судить по его окраске: сильно окрашенное масло для работы непригодно.
Рис. 1. Стеклянный ртутный диффузионный насос
Рис. 2Стеклянный высоковакуумный масляный двухступенчатый диффузионный насос.
После удаления масла из прибора внутреннюю часть насоса промывают четыреххлористым углеродом. Перед наполнением насоса маслом все остатки растворителя должны быть полностью удалены.
Защита кластеров.
Вопросы противоположным командам.
- Всем спасибо за внимание! Оценки выставлю после проверки тестов.
Отчет урока физики в 10 классе.
Данный урок представлен в ходе изучения раздела «Основы молекулярно-кинетической теории». На уроке были учтены возрастные и психологические особенности учащихся, использованы информационно-коммуникативные технологии.
Целью урока является : изучить свойства газов и их применение в технике
Основные задачи урока:
воспитательные : формировать рефлексию, привычку оказывать помощь и поддержку друг другу при выполнении практической работы, добросовестное отношение к выполняемому заданию;
развивающие : развитие речи, памяти, внимания, интереса к предмету, умения работать с физическими приборами, с учебником, дополнительной литературой, умения выделять главное,
образовательная : применять знания на практике.
На уроке были использованы элементы обучения школьников универсальным учебным действиям, применялся деятельностный метод обучения, который был реализован в следующих видах деятельности: учебной и учебно-исследовательской. На всех этапах урока ученики были вовлечены в активную мыслительную и практическую деятельность исследовательского характера, детям надо было не только использовать уже имеющиеся знания.
Урок проведен в стандартной форме с применением новых технологий.
Этапы урока были тесно взаимосвязаны между собой, чередовались различные виды деятельности. Все этапы урока были последовательными и логически связанными. Структура урока соответствует данному типу урока. Обеспечивалось целостность и завершенность урока. Умственные действия опирались и подкреплялись практическими. Класс разделился на две команды.
Одна группа изучала тему «Свойства газов и применение газов», а вторая группа «газ как рабочее тело двигателя. Разреженные газ. Получение глубокого вакуума».
Каждая группа должна была создать кластер по теме и защитить его, а так же объяснить понятно и доступно другой команде тему их выступления.
В ходе мною были использованы следующие методы обучения: словесный, частично-поисковый, наглядный, проблемно-диалогичный. Эти методы обучения обеспечивали поисковый и творческий характер познавательной деятельности учащихся, а так же были использованы следующие наглядные, литературные и технические материалы:
Урок прошел организованно, был логический переход от одного этапа к другому, было четкое управление учебной работой учащихся, владение классом, соблюдение дисциплины. Интенсивность урока была оптимальной с учётом физических и психологических особенностей детей.
Данная презентация хорошо подходит для изложения материала в 10 классе по профильному курсу физики. Тема урока раскрывает основные понятия: 1. удельная теплота парообразования
2. относительная влажность воздуха и абсолютная влажность воздуха
Также в презентации рассмотрены применение в промышленности сжиженных гагов и их получение. Приборы для измерения влажности воздуха
Скачать:
Подписи к слайдам:
Теплота парообразованияСжижение газовВлажность воздуха Это количество теплоты, требующееся для превращения данной массы жидкости в пар той же температурыQп, Дж Q, Дж
Теплота парообразования Куда расходуется подводимая к телу энергия? На увеличение его внутренней энергии при переходе из жидкого состояния в газообразное теплота парообразования зависит от рода жидкости, ее массы и температуры.эта зависимость характеризуется – удельной теплотой парообразования - r, Дж/кг Удельной теплотой парообразования данной жидкости называется отношение теплоты парообразования жидкости к его массеr=Qп/mr – удельная теплота парообразованияm - масса жидкости Qп=rm – энергия, которая поглощается при парообразовании, ДжQк= -rm – энергия, которая выделяется при конденсации пара, Дж Сжижение газов В 1799 г. первый газ (аммиак) был обращен в жидкостьАнглийский физик М.Фарадей сжижал газы путем их одновременного охлаждения и сжатияКо второй половине 19 века остались не обращенными только 6 газов: водород, кислород, азот, оксид азота и метан (т.к. не было техники для получения низких температур) Установки для сжижения газов Детандеры (расширители) низкого давления разработаны академиком П.Л. Капицей 1- компрессор, туда поступает атмосферный воздух, где сжимается до давления в несколько десятков атмосфер2 – теплообменник, в нем охлаждается проточной водой горячий воздух и поступает в цилиндр детандера (3) – здесь он расширяясь, толкает поршень, и охлаждается настолько сильно, что конденсируется в жидкость4 – сосуд, куда поступает сжиженный воздух
Получение жидкого воздуха
Хранение жидких газов Сосуд Дьюара1) Устроен, как термос, имеет двойные стеклянные стенки, между которыми нет воздуха2) Внутренняя стенка блестящая - для уменьшения нагревания излучением3) Узкое открытое горлышко, чтобы содержащийся в сосуде газ имел возможность постепенно испаряться4) При испарении, сжиженный газ остается холодным5) Жидкий воздух сохраняется в течение нескольких недель Применение сжиженных газов
В технике для разделения воздуха на составные части. Метод основан на том, что различные газы, из которых состоит воздух, кипят при различных температурах2) Жидкий кислород используется в качестве окислителя для двигателей космических ракет3) Жидкий водород – топливо в космических ракетах4) Жидкий аммиак применяется в холодильниках – огромных складах, где хранятся продукты
Влажность воздуха
Парциальное давление водяного пара – давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали
абсолютная влажность воздуха – плотность водяного пара, кг/м3 показывает, сколько водяного пара содержится в 1 м3 воздуха
-абсолютная влажность, кг/м3плотность насыщенного водяного пара при данной температуре, кг/м3парциальное давление водяного пара, Па давление насыщенного пара, Па
Относительная влажность воздуха Показывает, насколько водяной пар при данной температуре близок к насыщению Точка росы – температура, до которой должен охладиться воздух, чтобы находящийся в нем пар достиг состояния насыщения (при данной влажности воздуха и неизменном давлении) Конденсационный гигрометр1- металлическая коробка2 – передняя стенка3 – кольцо4 – теплоизолирующая прокладка5 – резиновая груша
Приборы, для измерения влажности воздуха Волосной гигрометр1-металлическая стойка2- обезжиренный человеческий волос3 – гайка4 – стрелка5 - блок
Приборы, для измерения влажности воздуха Психрометр
Приборы, для измерения влажности воздуха
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если:
а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;
б) газ очень разряжен, т. е. расстояние между молекулами намного больше размеров самих молекул;
в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных.
Основными параметрами идеального газа являются давление, объем и температура.
Одним из первых и важных успехов МКТ было качественное и количественное объяснение давления газа на стенки сосуда.Качественное объяснение заключается в том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда.
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: р = 1/3 т 0 пv 2 .
Здесь р - давление идеального газа, m 0 -
масса молекулы, п - концентрация молекул, v 2 - средний квадрат скорости молекул.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа Е k получим основное уравнение МКТ идеального газа в виде: р = 2/3nЕ k .
Однако, измерив только давление газа, невозможно узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужно измерение какой-то еще физической величины, связанной со средней кинетической энергией молекул. Такой величиной в физике является температура.Температура - скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетическая величина характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией.
E k = 3/2 kT, где k = 1,38 10 -23 Дж/К и называетсяпостоянной Больцмана.
Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О °С принята точка замерзания воды, за 100 °С принята точка кипения воды при нормальном атмосферном давлении).
2. Электрический ток в растворах и расплавов электролитов . Закон электролиза. Применение электролиза в технике.
Вещества, которые проводят электрический ток называются электролитами. Изменение химического состава раствора или расплава при прохождении через него электрического тока. Обусловленное потерей или присоединении электронов ионами, называют электролизом.
Майкл Фарадей установил, что при прохождении эл. тока через электролит масса вещества m, выделившегося на электроде, пропорциональна заряду q, прошедшего через электролит:
m=k*q или m=k*I*t.
Зависимость, полученную Фарадеем, называют законом электролиза. Коэффициент пропорциональности k называется электрохимическим эквивалентом.
k=1/e*N a * M/n ==> m=1/e*N a * M/n *I *t.
Коэффициент k численно равен массе выделившегося на электродах вещества при переносе ионами заряда в 1 Кл:
k=m/q; [k]=кг/Кл.
Произведение заряда электрона на число Авогадро называется числом Фарадея: 96500 Кл/моль.
Число Фарадея это электрический заряд, переносимый веществом в количестве 1 моль при электролизе.
В электрическом поле ионы электролита приходят в движение: положительные ионы движутся к катоду, а отрицательные к аноду. Так возникает электрический ток в электролите. При встречи положительного и отрицательного ионов, происходит их соединение – рекомбинация.
С помощью электролиза из солей и оксидов получают многие металлы. Электролитический способ дает возможность получать вещества с малым количеством примесей. Путем электролиза можно наносить тонкие слои металлов, эти слои могут служить защитой изделия от окисления. Такой способ называется – гальваностегией.
При длительном пропускании тока, получается толстый слой металла, который может быть отделен с сохранением формы – гальванопластика. Явление электролиза лежит в основе принципа действия кислотных и щелочных аккумуляторов, где используют обратимость процесса электролиза.
Слайд 2
Цели урока:
изучить газовые законы; научиться объяснять законы с молекулярной точки зрения; изображать графики процессов; продолжить обучение решать графические и аналитические задачи, используя уравнение состояния и газовые законы.
Слайд 3
Что является объектом изучения МКТ? Что в МКТ называют идеальным газом? Для того чтобы описать состояние идеального газа используют три термодинамических параметра. Какие? Назовите микроскопические параметры идеального газа и макроскопические параметры. Как создаётся давление? Как термодинамический параметр давления связан с микроскопическими параметрами? Как объём связан с микроскопическими параметрами?
Слайд 4
Изопроцессы в газах
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Рассмотрим следующие изопроцессы:
Слайд 5
Газовый закон –количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего.
Газовых закона, как и изопроцесса – три. Первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, Уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И.Менделеевым.
Слайд 6
План изучения нового материала
Определение процесса, история открытия Условия применения Формула и формулировка закона Графическое изображение Пример проявления
Слайд 7
Изотермический процесс -
процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Условия выполнения: Т – const, m – const, хим. состав – const. Р1V1 = Р2V2 или РV=соnst (закон Бойля – Мариотта). Р. Бойль 1662 Э. Мариотт 1676 Если T = const, то приV↓ p, и наоборот V p↓ р, Па 0 V, м³ изотермы Т2 Т1 Т2 >Т1 0 р, Па Т, К 0 V, м³ Т, К
Слайд 8
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха.
Пример проявления: А) сжатие воздуха компрессором Б) расширение газа под поршнем насоса при откачивании газа из сосуда.
Слайд 9
Газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине. Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
Слайд 10
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и в следствие образовавшегося перепада давлений происходит вдох. Применение закона Бойля-Мариотта
Слайд 11
Применение закона Бойля-Мариотта
Другими словами воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выровняются. Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
Слайд 12
Изобарный процесс -
процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Условия выполнения Р – const, m – const, хим. состав – constV1/T1 = V2/T2 . V/Т = const (закон Гей-Люссака). Ж. Гей-Люссак 1802 Если р = const, то приТ↓ V↓, и наоборот T V V, м³ 0 Т, К изобары р2 р1 р2
Слайд 13
Пример проявления
Расширение газа в цилиндре с подвижным поршнем при нагревании цилиндра
Слайд 14
Изохорный процесс -
процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Условия выполнения: V – const, m – const, хим. состав – const. p/Т = const илиP1/T1 = P2/T2(закон Шарля). Ж. Шарль 1787 Если V = const, то приТ↓ p↓, и наоборот T p P, Па 0 Т, К Изохоры V2 V1 V2
Слайд 15
Пример проявления
Нагревание газа любой закрытой емкости, например в электрической лампочке при ее включении.
Слайд 16
1834г. Французский физик Клапейрон, работавший длительное время в Петербурге, вывел уравнение состояния идеального газа при постоянной массе газа (m=const).
Р= n0 к T– основное уравнение М.К.Т., так как n0 – число молекул в единице объема газа n0 = N/VN - общее число молекул т.к. m=const, N - остается неизменным (N= const) P= NкT/VилиPV/T = Nⱪ где Nк - постоянное число, то PV/T = constP1V1 / T1 = P2V2 / T2- уравнение Клапейрона
Слайд 17
Если взять произвольную массу газа m при любых условиях, то уравнение Клапейрона примет вид:
PV = m/M·RT- уравнение Клапейрона-Менделеева Это уравнение в отличии от предыдущих газовых законов связывает параметры одного состояния. Оно применяется, когда в процессе перехода газа из одного состояния в другое меняется масса газа.
Слайд 18
Особенность газообразного состояния
1. В свойствах газов: - Управление давлением газа - Большая сжимаемость - Зависимость p и V от Т 2. Использование свойств газов в технике.
Слайд 19
Использование свойств газов в технике
Газы в технике, применяются главным образом в качестве топлива; сырья для химической промышленности: химических агентов при сварке, газовой химико-термической обработке металлов, создании инертной или специальной атмосферы, в некоторых биохимических процессах. Газы также применяют в качестве амортизаторов (в шинах), рабочих тел в двигателях (тепловых на сжатом газе), двигателях внутреннего сгорания.
Увеличение давления газа при его сжатии, приводящее к свойству, которое выше было названо упругостью, используется во многих механизмах. Предварительно сжатый газ, расширяясь, может совершать механическую работу. Кроме того, хорошая сжимаемость газов позволяет в относительно небольших объемах хранить значительные их количества. Таким образом, для многих производств необходим сжатый газ. Машина, служащая для сжатия газа до избыточного давления не ниже 0,2 МПа, называется компрессором. (Машины, сжимающие газ до меньшего давления, называются вентиляторами). Одним из видов компрессора является поршневой компрессор, основные части которого – это кривошипный механизм, цилиндр, клапаны и фильтр.
Сжатый воздух используется, в частности, в пневматических отбойных молотках – ручных машинах ударного действия, которые, в свою очередь, применяются для отделения горных пород от массива, разрыхления уплотненного грунта, разборки каменных или кирпичных кладок.
Очень хорошая сжимаемость воздуха и возможность регулировать давление, позволяет использовать его в качестве эффективного амортизатора.
Сжатый воздух используется для пневмотранспортировки по трубам грузов, заключенных в специальные капсулы.
На речном и морском транспорте используются суда на воздушной подушке.
Зависимость давления газа или его объема от температуры используется в газовых термометрах.
При сгорании горючей смеси в цилиндре, температура газа резко повышается, его давление возрастает, и газ, расширяясь, совершает работу.
Находят применение и разреженные газы. Например, доильная установка на крупной ферме работает за счет разряжения, создаваемого вакуумным насосом.
В медицине, для тренировки летчиков и космонавтов, используются барокамеры – герметично закрытые помещения, объемом от нескольких десятков литров до сотен кубометров, в которых можно установить повышенное или пониженное давление, создать искусственную атмосферу.
Свойство газов расширяться при нагревании и тем самым уменьшать свою плотность, было использовано еще в 1783 г. братьями Монгольфьер при постройке и запуске воздушного шара. Воздушные шары и по сей день запускают, нагревая воздух внутри их оболочки с помощью мощных горелок.
Газы с плотностью, меньшей чем у воздуха (водород, гелий), используются для создания подъемной силы в аэростатах. Для наблюдений, воздушных заграждений используются привязные аэростаты. Свободные аэростаты летают с экипажем или без него в направлении воздушных течений. Аэростаты, служащие для полетов в стратосферу, называются стратостатами.
Управляемые с помощью винтовых двигателей аэростаты называются дирижаблями. Дирижабли обладают очень большой грузоподъемностью и имеют большую дальность полета. Эти свойства дирижаблей позволяют использовать их в труднодоступных удаленных районах, для перевозки крупногабаритных уникальных грузов.