Так и в виде различных соединений. В свободном состоянии в природе встречаются такие металлы, которые трудно окисляются кислородом воздуха, например, платина, золото, серебро, значительно реже ртуть, медь и др.
Самородные металлы обычно содержатся в небольших количествах в виде зерен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов - самородки. Так, из найденных самый крупный самородок меди весил 420 т, серебра - 13,5 т, а золота - 112 кг.
Большинство металлов в природе существует в связанном состоянии в виде различных химических природных соединений - минералов. Очень часто это оксиды, например минералы железа: красный железняк, бурый железняк, магнитный железняк Fe3O4. Нередко минералами являются сульфидные соединения, например свинцовый блеск РbS, цинковая обманка, или галенит ZnS, киноварь НgS.
Минералы входят в состав горных пород и руд. Рудами называют содержащие минералы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности .
По химическому составу минерала, входящего в руду, различают оксидные, сульфидные и другие руды.
Обычно перед получением металлов из руды ее предварительно обогащают - отделяют пустую породу, примеси и т. д., в результате образуется концентрат, служащий сырьем для металлургического производства.
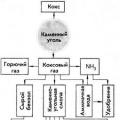
Металлургия - это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. Такое же название имеет и важнейшая отрасль тяжелой промышленности, занимающаяся получением металлов и сплавов .
В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Пирометаллургия - методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах (греч. пирос - огонь).
Пирометаллургические процессы включают обжиг, при этом содержащиеся в рудах соединения металлов, в частности сульфиды, переводятся в оксиды, а сера удаляется в виде оксида серы(1V) SO2, например:
2СuS + 3O2 = 2СuО + 2SO2
и плавку, при этом происходит восстановление металлов из их оксидов с помощью угля, водорода, оксида углерода(П), более активного металла, например:
2СuО + С = 2Сu + СO2
Сr2O3 + 2Аl = Аl2O3 + 2Сr
Если в качестве металла-восстановителя используется алюминий , то соответствующий процесс восстановления называется алюминотермией. Этот метод получения металлов был предложен русским ученым Н. Н. Бекетовым.
Николай Николаевич Бекетов
Русский физико-химик. Способствовал развитию физической химии как самостоятельной области науки. Открыл химический процесс вытеснения металлов из растворов их солей под действием других металлов и водорода.
Гидрометаллургия - методы получения металлов, основанные на химических реакциях, происходящих в растворах.
Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, например, действием серной кислоты переводят в раствор соли меди, цинка и урана, а обработкой раствором соды - соединения молибдена и вольфрама с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия
- методы получения металлов, основанные на электролизе, т. е. выделении металлов из растворов или расплавов их соединений при пропускании через них постоянного электрического тока . Этот метод применяют главным образом для получения очень активных металлов - щелочных, щелочноземельных и алюминия, а также для производства легированных сталей. Именно этим методом английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.
Гемфри Дэви
(1778-1829)
Английский химик и физик. Один из основателей электрохимии. Путем электролиза солей и щелочей получил калий, натрий, барий, кальций, амальгаму (раствор металла в ртути) стронция и магния.
Большого внимания заслуживают микробиологические методы получения металлов, в которых используется жизнедеятельность некоторых видов бактерий. Например, так называемые тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. В частности, такой бактериальный метод применяется для извлечения меди из ее сульфидных руд непосредственно на месте их залегания. Далее рабочий раствор, обогащенный сульфатом меди(II), подается на гидрометаллургическую переработку.
1. Самородные металлы.
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиБольшинство металлов находятся в природе в виде соединений с другими элементами, и только немногие встречаются в чистом виде, например: серебро, золото, медь, свинец. Минералы (природные химические соединения) и горные породы, содержащие соединения металлов называются рудами . Руды содержат оксиды, сульфиды, карбонаты, галогениды металлов. Получение металлов из руд составляет задачу металлургии.
Металлургические процессы,протекающие при высоких температурах, называются пирметаллургическими. Таким путем получают чугун и сталь, используя вещества-восстановители.
Важнейшими восстановителями являются углерод и монооксид углерода. Для металлов, не восстанавливаемых ни углеродом, ни СО, используют более сильные восстановители: водород, кремний и некоторые достаточно активные металлы – магний, алюминий. Методы, в которых в качестве восстановителей используют металлы, называются металлотермией (иногда в названии присутствует металл-восстановитель, например: алюмотермия).
Примеры процессов c использованием различных восстановителей.
Fe 2 O 3 + 3CO = 3Fe + 3CO 2
Иногда, при переработке сульфидных руд, проводят первоначальный обжиг в специальных печах – окисляют руду до оксидов, и только затем восстанавливают до металла:
2ZnS + O 2 = 2ZnO + 2SO 2 ZnO + C = Zn + CO
Такие металлы, как хром, марганец, получают, главным образом, алюмотермией, а также восстановлением кремнием:
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
Процесс алюмотермии протекает с большим выделением теплоты.
Процессы извлечения металлов из руд с помощью водных растворов называются гидрометаллургическими. Таким путем получают золото. Золотосодержащую породу обрабатывают раствором NaCN, и золото переходит в раствор в виде комплекса - . Затем используют цинк в качестве восстановителя:
2 - + Zn = 2- + Au
Третьим способом получения металлов является электролиз растворов или расплавов. Электролизом раствора оксида алюминия в расплавленном криолите получают алюминий; электролизом расплава MgCl 2 получают магний.
Получение металлов высокой чистоты.
В ряде отраслей техники требуется получение металлов высокой степени чистоты. Например, для ядерных реакторов нужен химически чистый цирконий без примеси гафния. Для электронной промышленности необходим германий, в котором не должно быть более одного атома фосфора, мышьяка или сурьмы на миллион атомов германия. Исследование металлов в чистом состоянии показало, что некогда существовавшие представления об их свойствах являются ошибочными. Так, например, чистые титан, хром оказались настолько пластичными, что их можно ковать, прокатывать в тонкие листы и пр. Алюминий высокой чистоты мягок, как свинец, а его электропроводимость значительно выше.
Чистые металлы можно получить электролизом, но степень их чистоты недостаточно высокая, поэтому для получения металлов ОСЧ – особой чистоты, используют специальные методы:
Переплавка в вакууме (получают ОСЧ литий, щелочно-земельные металлы, хром, марганец, бериллий);
Разложение летучих соединений на раскаленной поверхности (получают ОСЧ титан, цирконий, хром, тантал, ниобий, кремний и др.);
Использование так называемой «зонной плавки» (получают германий, кремний, олово, алюминий, висмут и галлий).
Зонная плавка основана на различной растворимости примесей в твердой и жидкой фазах очищаемого металла. Лодочку или тигель специальной формы со слитком металла передвигают с очень медленной скоростью (несколько мм в час) через печь При этом происходит расплавление небольшого участка (зоны) металла. По мере продвижения тигля зона жидкого металла перемещается от одного конца слитка к другому. Примеси, содержащиеся в металле, собираются в зоне плавления, перемещаются вместе с ней и после окончания плавки оказываются в конце слитка. Многократное повторение операции дает возможность получить металл высокой степени чистоты.
Дополнения к теме «Физико-хмический анализ»
Многочисленные работы Ник. Семен. Курнакова по выяснению природы металлических сплавов внесли ясность в понимание процессов, происходящих при затвердевании сплавов. В частности, при изучении сплавов были открыты химические соединения, состав которых может меняться в широких пределах. Эти соединения, состав которых может меняться в широких пределах, Курнаков назвал бертоллидами, по имени французского химика Бертолле, допустившего их существование. Тогда как соединения постоянного состава (подчиняющиеся закону постоянства состава), были названы дальтониды. Стехиометрическое соотношение компонентов, образующих химическое соединение постоянного состава соблюдается только в парообразном состоянии, в молекулярных кристаллах и жидкостях. Исходя из вышесказанного, можно дать более развернутое определение, что такое химическое соединение. Химическое соединение – это вещество постоянного или переменного состава, образованное из атомов одного или нескольких химических элементов, с качественно своеобразным химическим и кристаллохимическим строением.
При сплавлении металлов может образоваться твердый раствор или химическое соединение переменного состава. В отличие от твердых растворов (общее между растворами и хим. соединениями – однородность и наличие теплового эффекта при образовании), соединение переменного состава характеризуется только ему присущим кристаллохимическим строением, отличающимся от строения исходных компонентов.
Условием образования
Общие способы получения металлов.
Способы получения металлов обычно разделяют на:
- пирометаллургические (восстановление при высоких температурах);
- гидрометаллургические (восстановление из солей в растворах);
- электрометаллургические (электролиз раствора или расплава);
- биометаллургические.
I. Пирометаллургический способ получения металлов.
1. Карботермический способ получения металлов − восстановление металлов из оксидов углем или угарным газом
Mе x O y + C = CO 2 + Me,
Mе x O y + C = CO + Me,
Mе x O y + CO = CO 2 + Me
Например,
ZnO+ C = CO + Zn
Fe 3 O 4 + 4CO = 4CO 2 + 3Fe
MgO + C = Mg + CO
2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия – Mе x S y +O 2 =Mе x O y +SO 2
2 стадия − Mе x O y + C = CO 2 + Me или Mе x O y + CO = CO 2 + Me
Например,
2ZnS + 3O 2 = 2ZnO + 2SO 2
MgCO 3 = MgO + CO 2
3. Металлотермический способ (способ получения металлов, в котором в качестве восстановителя применяют металлы)
В этом способе в качестве восстановителя используют активные металлы. Примеры металлотермических реакций:
А) Алюмотермия (в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида)
Mе x O y + Al = Al 2 O 3 + Me
Например,
4SrO + 2Al = Sr(AlO 2) 2 + 3Sr
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3
3BaO + 2Al = 3Ba + Al 2 O 3 (получают барий высокой чистоты)
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
Б) Магниетермия:
Mе x O y + Mg = MgO + Me
TiCl 4 + 2Mg = Ti + 2MgCl 2
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
4. Водородотермия − для получения металлов особой чистоты
Mе x O y + H 2 = H 2 O + Me
Например,
WO 3 + 3H 2 = W + 3H 2 O
MoO 3 + 3H 2 = Mo + 3H 2 O
II. Гидрометаллургический способ получения металлов.
Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
затем проводят реакцию замещения:
CuSO 4 + Fe = FeSO 4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде:
2ZnS + 3O 2 = 2ZnO + 2SO 2
б) из карбоната – разложением при нагревании:
СаСО 3 = СаО + СО 2
III. Электрометаллургический способ получения металлов − восстановление металлов электрическим током (электролиз).
1. Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (чаще всего хлоридов):
2NaCl – расплав, электр. ток → 2Na + Cl 2
CaCl 2 – расплав, электр. ток. → Ca + Cl 2
расплавов гидроксидов:
4NaOH – расплав, электр. ток. → 4Na + O 2 + 2H 2 O (!!! используют изредка для Na)
2. Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 – расплав в криолите, электр. ток. → 4Al + 3O 2
3. Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O – раствор, электр. ток → 2Cu + O 2 + 2H 2 SO 4
Металлы в природе.
Металлы в природе встречаются в трёх формах.
1) В свободном виде встречаются золото и платина; золото бывает в распыленном состоянии, а иногда собирается в большие массы самородки. Так в Австралии в 1869 году нашли глыбу золота в сто килограммов весом. Через три года обнаружили там же еще большую глыбу весом около двухсот пятидесяти килограммов. Наши русские самородки много меньше, и самый знаменитый, найденный в 1837 году на Южном Урале, весил всего около тридцати шести килограммов. В середине XVII века в Колумбии испанцы, промывая золото, находили вместе с ним тяжелый серебристый металл. Этот металл казался таким же тяжелым, как и золото, и его нельзя было отделить от золота промывкою. Хотя он и напоминал серебро, но был почти нерастворим и упорно не поддавался выплавке; его считали случайной вредной примесью или преднамеренной подделкой драгоценного золота. Поэтому испанское правительство приказывало в начале XVIII столетия выбрасывать этот вредный металл при свидетелях обратно в реку. Месторождения платины находятся и на Урале. Оно представляет собой массив дунита (изверженная горная порода, состоящая из силикатов железа и магния с примесью железняка). В нем содержатся включения самородной платины в виде зерен. В самородном виде и в форме соединений могут находиться в природе серебро, медь, ртуть и олово.
2) Все металлы. Металлы средней и малой активности, которые в ряду напряжений находятся до олова, в природных условиях встречаются только в виде соединений − образуют оксиды и сульфиды. Реже их можно встретить в составе сложных кислотно-металлических соединений.
3) Химически активные элементы встречаются либо в виде простых солей, либо в виде полиэлементных соединений, которые имеют очень сложное химическое строение, но в основном достаточно просто разлагаются на составляющие при определенном воздействии.
Чаще всего металлы в природе встречаются в виде солей неорганических кислот:
хлоридов сильвинит КСl NaCl, каменная соль NaCl;
нитратов – чилийская селитра NaNO 3 ;
сульфатов – глауберова соль Na 2 SO 4 10 H 2 O, гипс CaSO 4 2Н 2 О;
карбонатов – мел, мрамор, известняк СаСО 3 , магнезит MgCO 3 , доломит CaCO 3 MgCO 3 ;
сульфидов серный колчедан FeS 2 , киноварь HgS, цинковая обманка ZnS;
фосфатов – фосфориты, апатиты Ca 3 (PO 4) 2 ;
оксидов – магнитный железняк Fe 3 O 4 , красный железняк Fe 2 O 3 , бурый железняк, содержащий различные гидроксиды железа (III) Fe 2 O 3 Н 2 О.
Ещё в середине II тысячелетия до н. э. в Египте было освоено получение железа из железных руд. Это положило начало железному веку в истории человечества, который пришёл на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами .
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией . Так же называется и наука о промышленных способах получения металлов из руд.
Металлургию подразделяют на черную (производство железа и его сплавов) и цветную (производство остальных металлов).
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла.
3. Промышленные способы получения металлов.
При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Существует несколько способов получения металлов в промышленности. Их применение зависит от химической активности получаемого элемента и используемого сырья. Некоторые металлы встречаются в природе в чистом виде, другие же требуют сложных технологических процедур для их выделения. Добыча одних элементов занимает несколько часов, другие же требуют многолетней обработки в особых условиях. Общие способы получения металлов можно разделить на следующие категории: восстановление, обжиг, электролиз, разложение.
Есть также специальные методы получения редчайших элементов, которые подразумевают создание специальных условий в среде обработки. Сюда может входить ионная декристаллизация структурной решетки или же наоборот, проведение контролируемого процесса поликристаллизации, которые позволяют получать определенный изотоп, радиоактивное облучение и другие нестандартные процедуры воздействия. Они используются довольно редко ввиду высокой дороговизны и отсутствия практического применения выделенных элементов. Поэтому остановимся подробнее на основных промышленных способах получения металлов. Они довольно разнообразны, но все основаны на использовании химических или физических свойств определенных веществ.
Металлы в природе могут находиться в виде минералов, горных пород, водных растворов. Только немногие (Au, Pt, отчасти Ag, Cu, Hg) встречаются в свободном состоянии.
Минерал – индивидуальное вещество с определенной кристаллической структурой (например, мел, мрамор – это карбонат кальция). Горная порода – смесь минералов. Горная порода, содержащая значительное количество металлов, называется рудой. Водные растворы – океанская и морская вода; минеральная вода (в растворах металлы находятся в виде солей).
Металлургия – это наука, которая изучает и разрабатывает промышленные методы получения металлов из руд.
Перед тем, как получать металлы, руду обогащают (концентрируют), т. е. отделяют от пустой породы.
Существуют различные способы обогащения руд. Чаще всего применяется флотационный, гравитационный и магнитный способы.
Например, содержание меди в эксплуатируемых рудах обычно не превышает 1 %, поэтому необходимо предварительное обогащение. Оно достигается применением метода флотации руд, основанного на различных адсорбционных свойствах поверхностей частиц сернистых металлов и окружающей их пустой породы силикатного типа. Если в воде, содержащей небольшую примесь малополярного органического вещества (например, соснового масла), взболтать порошок тонко измельченной медной руды и сквозь всю систему продувать воздух, то частицы сернистой меди будут вместе с воздушными пузырьками подниматься вверх и перетекать через край сосуда в виде пены, а частицы силикатов осядут на дно. На этом основан флотационный метод обогащения, при помощи которого ежегодно перерабатывается более 100 млн т сернистых руд различных металлов. Обогащенная руда – концентрат – содержит обычно от 20 до 30 % меди. При помощи селективной (избирательной) флотации удается не только отделять руду от пустой породы, но и разделять отдельные минералы полиметаллических руд.
Металлургические процессы разделяют на пирометаллургические и гидрометаллургические.
Пирометаллургия – восстановление металлов из их соединений (оксидов, сульфидов и др.) в безводных условиях при высоких температурах.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига, а затем восстанавливают оксиды углем или СО:
ZnS + 3O 2 = 2 ZnO + 2SO 2 ; 2PbS + 3O 2 = 2 PbO + 2SO 2 ;
ZnO + C = Zn + CO; PbO + C = Pb + CO.
Пирометаллургическим способом получают, например, чугун и сталь.
Однако не все металлы можно получить восстановлением их оксидов углем или СО, поэтому применяют более сильные восстановители: водород, магний, алюминий, кремний. Например, такие металлы, как хром, молибден, железо получают алюминотермией :
3Fe 3 O 4 + 8Al = 9Fe + 4Al 2 O 3 .
Гидрометаллургия – извлечение металлов из руд с помощью водных растворов тех или иных реагентов.
Например, руду, содержащую основную соль (CuOH) 2 CO 3 , обрабатывают раствором серной кислоты:
(CuOH) 2 CO 3 + 2H 2 SO 4 = 2CuSO 4 + 3H 2 O + CO 2 .
Из полученного раствора сульфата медь выделяют либо электролизом, либо действием металлического железа:
Fe + CuSO 4 = Cu + FeSO 4 .
Вытеснение одного металла другим из раствора его соли называется в технике цементацией.
Медь, цинк, кадмий, никель, кобальт, марганец и другие металлы получают электролизом растворов солей. Разряд ионов металла из растворов происходит на катоде:
Cu +2 + 2е – = Cu 0 .
В этих процессах используют нерастворимые аноды, на которых обычно выделяется кислород:
2H 2 O – 4е – → O 2 + 4H + .
Активные металлы (щелочные и щелочноземельные) получают электролизом расплавов, так как в воде эти металлы растворимы:
(катод, –): Mg +2 + 2е – = Mg 0 ; (анод, +): 2Cl – – 2е – = Cl 2 0 .
Способы очистки металлов
Свойства металлов зависят от содержания в них примесей. Например, титан долгое время не находил применения из-за хрупкости, обусловленной наличием примесей. После освоения методов очистки применение титана резко возросло. Особенно большое значение имеет чистота материалов в электронной, вычислительной технике и ядерной энергетике.
Рафинирование – процесс очистки металлов, основанный на различии физических и химических свойств металла и примесей.
Все методы очистки металлов можно разделить на химические и физико-химические.
Химические методы очистки заключаются во взаимодействии металлов с теми или иными реагентами, образующими с основными металлами или примесями осадки или газообразные продукты. Для получения высокочистых никеля, железа, титана применяется термическое разложение летучих соединений металла (карбоксильный процесс, иодидный процесс).
Рассмотрим, например, получение циркония. В замкнутой системе находятся пары йода и сырой цирконий. Температура в реакционном сосуде 300 ºС. При этой температуре на поверхности циркония образуется летучий тетраиодид циркония:
Zr (тв)+ 2I 2 (г) ↔ ZrI 4 (г).
В реакционном сосуде находится вольфрамовая нить, раскаленная до 1500 ºС. За счет высокой обратимости данной реакции иодид циркония осаждается на вольфрамовой нити и разлагается с образованием циркония.
Физико-химические методы включают в себя электрохимические, дистилляционные, кристаллизационные и другие способы очистки.
В металлургии легких и цветных металлов широко используется электролиз. Этот метод используют для очистки многих металлов: меди, серебра, золота, свинца, олова и др.
Рассмотрим, например, рафинирование черного никеля, содержащего примеси цинка и меди и служащего анодом в электролизере:
Е 0 Zn 2+ / Zn = – 0,76 В; Е 0 Cu 2+ / Cu = ,34 В; Е 0 Ni 2+ / Ni = – 0,25 В.
На аноде в первую очередь растворяется металл с наиболее отрицательным потенциалом. Так как
Е 0 Zn 2+ / Zn < Е 0 Ni 2+ / Ni < Е 0 Cu 2+ / Cu ,
то первым растворяется цинк, а затем основной металл – никель:
Zn – 2e – → Zn 2 + , Ni – 2e – → Ni 2 + .
Примесь меди, имеющая более положительный потенциал, не растворяется и выпадает в осадок (шлам) в виде частиц металла. В растворе окажутся ионы Zn 2+ и Ni 2+ . На катоде в первую очередь осаждается металл с наиболее положительным потенциалом, т. е. никель. Таким образом, в результате рафинирования никель осаждается на катоде, медь выпадает в шлам, а цинк переходит в раствор.
Электролизом расплавов соединений получают алюминий, магний, натрий, литий, бериллий, кальций, а также сплавы некоторых металлов. К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора NaCl с получением газообразных хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве. Кроме того, электролизом получают фтор из расплава смеси HF и NaF, водород и кислород из воды (для снижения омических потерь электролиз ведут в растворе NaOH), диоксид марганца из раствора MnSO 4 и т. д.
Широко применяют зонную плавку , заключающуюся в том, что вдоль слитка (стержня) медленно перемещается зона нагрева и соответственно зона расплавленного металла. Некоторые примеси концентрируются в расплаве и собираются в конце слитка, другие – в начале слитка. После многократных прогонов отрезают начальную и конечную части слитка, остается очищенная средняя часть металла.
Сплавы металлов
Сплав – это система с металлическими свойствами, состоящая из двух или более металлов (один компонент может быть неметаллом).
Вопросы химического взаимодействия металлов между собой, а также с неметаллами, если продукты их взаимодействия сохраняют металлические свойства, изучает один из разделов неорганической химии – металлохимия .
Если расположить металлы в порядке усиления их химического взаимодействия друг с другом, то получится следующий ряд:
– компоненты не взаимодействуют друг с другом ни в жидком, ни в твердом состоянии;
– компоненты взаимно растворяются в жидком состоянии, а в твердом состоянии образуют эвтектику (механическая смесь );
– компоненты образуют друг с другом жидкие и твердые растворы любого состава (системы с неограниченной растворимостью );
– компоненты образуют между собой одно или несколько металлических соединений, называемых интерметаллическими (система с образованием химического соединения ).
Для изучения физических свойств сплавов в зависимости от их состава широко используют физико-химический анализ. Это позволяет обнаружить и изучить происходящие в системе химические изменения.
О химических превращениях в системе можно судить по характеру изменения разнообразных физических свойств – температур плавления и кристаллизации, давления пара, вязкости, плотности, твердости, магнитных свойств, электрической проводимости системы в зависимости от ее состава. Из различных видов физико-химического анализа более часто применяют термический анализ . В ходе анализа строят и изучают диаграммы плавкости, которые представляют собой график зависимости температуры плавления системы от ее состава.
Чтобы построить диаграмму плавкости, берут два чистых вещества и готовят из них смеси различного состава. Каждую смесь расплавляют и затем медленно охлаждают, отмечая через определенные промежутки времени температуру остывающего сплава. Таким образом получают кривую охлаждения. На рис. 1. приведены кривые охлаждения чистого вещества (1) и сплава (2 ). Переход чистого вещества из жидкого в твердое состояние сопровождается выделением теплоты кристаллизации, поэтому, пока вся жидкость не закристаллизуется, температура остается постоянной (участок bс, кривая 1 ). Далее охлаждение твердого вещества идет равномерно.
При охлаждении расплава (раствора) кривая охлаждения имеет более сложный вид (рис. 1, кривая 2). В простейшем случае охлаждения расплава двух веществ вначале происходит равномерное понижение температуры, пока из раствора не начинают выделяться кристаллы одного из веществ. Так как температура кристаллизации раствора ниже, чем чистого растворителя, то кристаллизация одного из веществ из раствора начинается выше температуры кристаллизации раствора. При выделении кристаллов одного из веществ состав жидкого расплава изменяется, и температура его затвердевания непрерывно понижается по мере кристаллизации. Выделяющаяся при кристаллизации теплота несколько замедляет ход охлаждения и поэтому, начиная с точки l на кривой 2, крутизна линии кривой охлаждения уменьшается. Наконец, когда расплав делается насыщенным относительно обоих веществ, начинается кристаллизация обоих веществ одновременно. Это отвечает появлению на кривой охлаждения горизонтального участка b`с`. Когда кристаллизация заканчивается, наблюдается дальнейшее падение температуры.
На основании кривых охлаждения смесей разного состава строят диаграмму плавкости. Рассмотрим наиболее типичные из них.
Похожая информация.
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2LiCl = 2Li + Cl 2
2NaCl = 2Na + Cl 2
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
2MeCl + Ca = 2Mе + CaCl 2 ,
где Ме – металл.
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
2Li 2 O + Si + 2CaO = 4Li + Ca 2 SiO 4
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Получение щелочноземельных металлов
Получение Be осуществляют по реакции восстановления его фторида. Реакция протекает при нагревании:
BeF 2 + Mg = Be + MgF 2
Магний, кальций и стронций получают электролизом расплавов солей, чаще всего – хлоридов:
CaCl 2 = Ca + Cl 2
Причем, при получении Mg электролизом расплава дихлорида для понижения температуры плавления в реакционную смесь добавляют NaCl.
Для получения Mg в промышленности используют металло- и углетермические методы:
2(CaO×MgO) (доломит) + Si = Ca 2 SiO 4 + Mg
Основной способ получения Ba – восстановление оксида:
3BaO + 2Al = 3Ba + Al 2 O 3
Получение алюминия
Алюминий получают электролизом расплава оксида этого элемента:
2Al 2 O 3 = 4Al + 3O 2
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na 3 и Al 2 O 3 . Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF 3 , CaF 2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Получение переходных металлов
Получение титана осуществляют в две стадии – сначала из получают хлорид титана из оксида, а затем восстанавливают его магнием:
TiO 2 + 2Cl 2 +2C = TiCl 2 + 2CO (800 – 1000C)
TiCl 2 + 2Mg = Ti + 2MgCl 2
Чистый ванадий получают из оксида ванадия (V) кальцийтермическим восстановлением или из VCl 3 и VI 2 магний – и йодотермическим восстановлением, соответственно:
V 2 O 5 + 5Ca = 5CaO + V
Для получения хрома используют алюмотермический способ:
Na 2 Cr 2 O 7 + 2C = Cr 2 O 3 + Na 2 CO 3 + CO
Cr 2 O 3 +2Al = Al 2 O 3 + 2Cr
Получение молибдена осуществляют — из оксидов (разложение или восстановление их водородом):
3MoO 2 = Mo + 2MoO 3
Основные способы получения марганца – электролиз MnSO 4 и восстановление оксидов кремнием:
2Mn 2 O 3 + 3Si = 4Mn + 3SiO 2
Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
Cu 2 O + C = 2Cu + CO (1)
CuSO 4 + Fe = Cu + FeSO 4 (2)
Некоторые металлы получают термическим разложением их неустойчивых соединений:
Ni(CO) 4 = Ni + 4CO
Примеры решения задач
ПРИМЕР 1
| Задание | При электролизе водного раствора медного купороса на аноде выделилось 2,8 л газа. Какой это газ? Что и в каком количестве выделилось на катоде? |
| Решение | Запишем уравнение протекания электролиза:
CuSO 4 ↔Cu 2+ + SO 4 2- K(-): Cu 2+ +2e = Cu A(+): 2H 2 O -4e = 4H + + O 2 2CuSO 4 + 2H 2 O = 2Cu + O 2 + 2H 2 SO 4 (под действие электрического тока) На аноде выделился кислород, на катоде – медь. Найдем количество вещества кислорода: v(O 2) = V(O 2)/V m v(O 2) = 2,8/22,4 = 0,125 моль По уравнению реакции число моль кислорода – 1 моль, а меди – 2 моль. Найдем реальное число моль меди: v(Cu) = 2× v(O 2) v(Cu) = 2×0,125 = 0,152 моль Найдем массу меди: m(Cu) = v(Cu) × M(Cu) m(Cu) =0,152 ×64 = 19,456 г |
| Ответ | На аноде выделился кислород, на катоде – медь. Масса меди 19,456 г. |